引言
saRNA作为一种新型技术,因为其低剂量、长表达的特点,在医疗领域展现出巨大潜力。mRNA领域新秀-saRNA如何复制?
saRNA的多领域应用
1
传染病预防
saRNA COVID-19疫苗:伦敦帝国理工学院报告了全球首个saRNA COVID-19疫苗的临床试验结果,23名参与者中,有20名产生了免疫反应。ARCT-154是首款上市的saRNA疫苗,由CSL与Arcturus therapeutics联合开发,已获日本厚生劳动省(PMDA)批准上市。 其他病毒疫苗:流感病毒、狂犬病病毒、寨卡病毒 (ZIKV)、RSV等病毒的疫苗已经在临床试验中。GSK 开发的狂犬病saRNA疫苗(RG SAM)目前在进行I期临床试验。此外,目前已报道了三种针对寨卡病毒(ZIKV)的saRNA候选疫苗,它们都使用ZIKV的膜前和包膜(prM-E)糖蛋白作为免疫原,并已在临床前研究中开发和测试。 2 肿瘤治疗
癌症疫苗:许多候选saRNA癌症疫苗已进入临床试验。各种临床试验表明,saRNA癌症疫苗可增强 T 细胞免疫反应并改善患者的预后和生存率。因此,这些疫苗为肿瘤治疗提供了新的工具和支持。嘉晨西海的JCXH-211已进入II期临床试验。其编码人IL-12的新型基于saRNA的治疗药物,用于治疗各种实体瘤。Vicinivax公司的Vvax001是基于SFV 载体的治疗性癌症疫苗,目前正在进行II期临床试验测试,以评估其治疗人瘤病毒(HPV)诱导的癌症的免疫原性、安全性和耐受性。AVX701是基于VEEV载体的癌症疫苗,表达修饰的癌胚抗原基因(CEA)。转移性结直肠癌患者的I/II期临床试验的初步结果表明,接种疫苗的患者表现出更强的T细胞免疫反应和更长的生存期。
3 蛋白替代
治疗性应用:在saRNA疫苗之外,使用saRNA技术也会用在蛋白质替代研究。目前,尚未有基于saRNA的蛋白替代药物在临床上获得批准。治疗性体外转录saRNA可用于治疗某些关键蛋白缺失或下调导致的疾病,这些疾病包括:与α-半乳糖苷酶A缺乏有关的法布里病、丙酰辅酶A羧化酶缺乏引发的丙酸血症、由凝血因子IX的缺乏引起血友病B以及由胰岛素缺乏等引起的糖尿病等;为了克服很多疾病,许多研究也在尝试利用适当的编码基因插入saRNA 构建体并允许身体产生必要的蛋白质以获得治疗效果。
4 再生医学
多能干细胞诱导:多能干细胞(iPSC)在再生医学领域具有巨大的潜力,它们能够无限增殖,并且能够分化成体内因疾病或损伤而丢失的各种细胞类型。iPSC的产生依赖于对转录因子Myc、Oct3/4、Sox2和Klf4的“重编程”基因进行诱导。通常这四个基因是通过逆转录病毒或慢病毒系统引入,进而整合到宿主细胞的基因组中。但这种重编程方法存在导致靶细胞基因组突变的风险,可能会对细胞造成不利影响,甚至可能引发肿瘤。有报道采用RNA技术进行非整合基因组编辑的方法,saRNA技术能以更省时、快速、高效的方式诱导细胞多能性。例如有研究表明,利用源自仙台病毒(SeV)的saRNA载体感染小鼠和人类的成纤维细胞14天即可编码四种改良的转录因子,并不会进行病毒感染现象;基于委内瑞拉马脑炎病毒(VEEV)的saRNA也能成功地将成人成纤维细胞和肾上皮细胞重编程为iPSC。
下一代saRNA—taRNA系统
技术原理:与非扩增线性mRNA相比,saRNA包含一个编码复制酶的额外序列。例如,VEEV编码的RNA中的复制酶序列长度可达7 kb。由于RNA稳定性与序列长度呈负相关,因此对RNA储存和运输提出了严格的要求。为了解决这个问题,最新报道了一种新的反式扩增RNA(taRNA)系统,即将编码RdRp复合体的序列和编码靶基因的序列分裂成两个独立的转录本进行递送,有助于减小mRNA大小,从而提高整体mRNA稳定性。
图1 saRNA与taRNA主要结构要素 优势与应用:taRNA系统由编码复制酶的非复制mRNA(non-replicating mRNA nrRNA)和编码目的基因的复制子(TR)构成,编码复制酶的nrRNA 包含mRNA的结构特征,仅在体内翻译形成复制酶蛋白,而TR除含有编码目的蛋白的基因外,还有saRNA特有的四个保守序列元件(CSE),CSE1在基因组的5′-UTR;CSE2在nsP1 ORF的5′-末端,根据其长度命名为52-nt CSE;CSE3被鉴定为亚基因组启动子(SGP),位于亚基因组RNA起始位点;CSE4在3′-末端。nrRNA编码产生复制酶蛋白后,复制酶会和TR上的CSE结合导致其反式扩增,nrRNA本身不会被复制扩增,因为其缺乏CSE。大量扩增的复制子则会在体内进一步表达目的蛋白。 与经典saRNA相比,taRNA系统被证明具有更高的翻译效率和更少的细胞翻译干扰。基于这种taRNA系统的流感血凝素抗原编码RNA已被证明可以强烈增强病毒免疫原表达,并在小鼠中诱导针对活病毒攻击的保护性免疫反应,剂量低至50 ng。虽然taRNA系统的复制酶和复制子能否转染到同一个细胞中尚未得到证实,但这种taRNA系统的普遍适用性值得进一步探索。 结语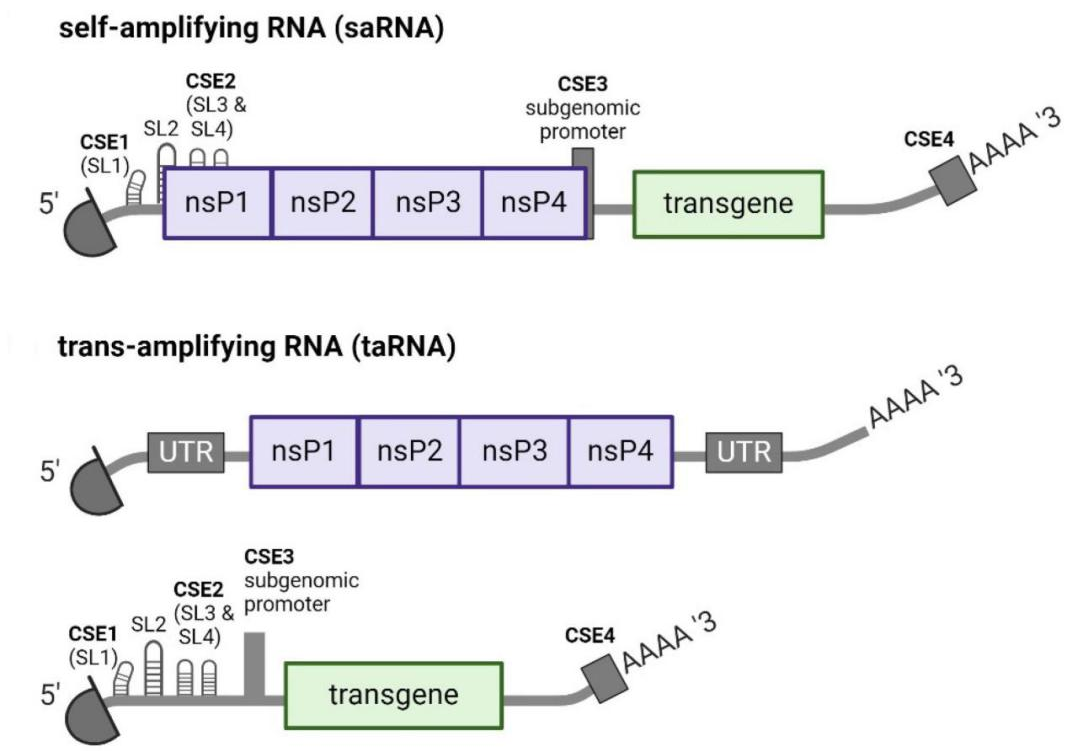
saRNA技术正重塑医疗未来:从全球首个获批的ARCT-154新冠疫苗,到显著提升肿瘤免疫疗效的JCXH-211疗法,再到罕见病蛋白替代和干细胞再生突破,这项技术已证明其跨领域价值。随着递送系统优化和临床转化加速,saRNA有望在未来5年内成为继单抗、CAR-T之后的下一个百亿美元级医疗技术平台,推动医学从"治疗症状"迈向"根治疾病"的新阶段。
参考文献 [1]Papukashvili D, Rcheulishvili N, Liu C, Ji Y, He Y, Wang PG. Self-Amplifying RNA Approach for Protein Replacement Therapy. Int J Mol Sci. 2022 Oct 25;23(21):12884. [1] Schmidt C, Schnierle BS. Self-Amplifying RNA Vaccine Candidates: Alternative Platforms for mRNA Vaccine Development. Pathogens. 2023 Jan 13;12(1):138. [2] Saw PE, Song E. Advancements in clinical RNA therapeutics: Present developments and prospective outlooks. Cell Rep Med. 2024 May 21;5(5):101555. [3] Zhou W, Jiang L, Liao S, Wu F, Yang G, Hou L, Liu L, Pan X, Jia W, Zhang Y. Vaccines' New Era-RNA Vaccine. Viruses. 2023 Aug 18;15(8):1760. [4] Hu C, Liu J, Cheng F, Bai Y, Mao Q, Xu M, Liang Z. Amplifying mRNA vaccines: potential versatile magicians for oncotherapy. Front Immunol. 2023 Oct 23;14:1261243. [5] Guo X, Li J, Wang HM, Qiu J, Li Z, Huang F, Li J, Sun XD. [Vaccine development based on RNA technology platforms]. Zhonghua Yu Fang Yi Xue Za Zhi. 2024 Aug 6;58(8):1263-1277.
特别声明:智慧医疗网转载其他网站内容,出于传递更多信息而非盈利之目的,同时并不代表赞成其观点或证实其描述,内容仅供参考。版权归原作者所有,若有侵权,请联系我们删除。
凡来源注明智慧医疗网的内容为智慧医疗网原创,转载需获授权。